Doygunluk
- Geniş anlamda doygunluk soyut kavramından sıyrılıp, günlük konuşma dilinde maksimum emmeyi ifade eder. Bilimsel anlamda ise doygunluk terimi çeşitli disiplinlerdeki olayları kapsar. Kimyacılar bir çözeltinin doygunluğundan bahsederler. İçinde katı bir maddenin çözünmüş olarak bulunduğu çözeltide; çok az katı ilavesinde katı maddenin çözünmeyip, dipte çökelti oluşturduğu durumlarda “doygun çözelti”den söz edilir.
- Organik kimyada doygunluğun önemi büyüktür. Organik bileşikler; üzerlerine hidrojen atomlarının bağlandığı karbon zincirlerinden oluşmuşlardır. Hidrojen atomları bağlanmış moleküle daha başka hidrojen atomunun bağlanmasının mümkün olmadığı durumlarda “doymuş hidrokarbonlardan” bahsedilir. Doymamış hidrokarbonlann özellikleri yeni hidrojen atomları bağlayabilirlerinden kaynaklanır. Bu reaksiyonlarla bileşik değişime uğrayarak doymuş hale geçer. Zincire hidrojenden, başka atomların da bağlanması, doymamış bir hidrokarbonu doymuş hale geçirir.
- Birkaç örnekle organik kimyadaki doygunluk kavramını açıklamaya çalışalım. En basit hidrokarbon metandır. Molekülü Ch4 aşağıdaki açık formül ile gösterilir,
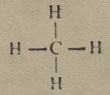
- Karbon elementi 4 değerlikli olduğundan ancak 4 element bağlayabilir. Metan durumunda artık başka hiçbir hidrojen atomu karbon’a bağlanamayacaktır. Metan molekülü doymuş bir moleküldür. Aynı sebeplerden ötürü etan C2H6‘nın açık formülü şöyle yazılır;
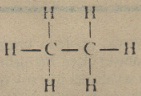
- Etan molekülü de doymuştur. Doymamış hidrokarbonların en basit üyesi etileridir. Etilen molekülünde 2 karbon atomu arasında çifte bağ vardır. Asetilen örneğinde ise üçlü bağ görmek mümkündür. Asetilenin C2H2 açık formülü;
H-C=C-H
- Genel olarak çifte veya üçlü bağlı hidrokarbonlar doymamıştır. Buna karşın kararlılıkları fazla olan tek bağlı hidrokarbon bileşikleri doymuştur.
- Organik kimyada bağların doyurulması doymamış bir bileşiği doymuş hale geçirir. Yani çifte veya üçlü bağların, basit bağlar haline dönüştürüldüğü reaksiyonlar “katılma reaksiyonları” olarak adlandırılırlar. Önceki örneklerde sadece hidrojen atomunun katılmasını inceledik. Bağların doyurulma prensibi; halojen katılma reaksiyonlarında (F, Cl, Br, I) veya asit katılma reaksiyonlarında (HF, HCl)da uygulanır.
- Kimyada moleküler düzeyde çok sayıda kullanılan doygunluk’a; bilimin diğer dallarında da rastlanır. Metereoloji’de doygunluk ile havadaki su buharı miktarı belirlenir. Bu su buharının yoğunlaşması ile; çiğ, sis ve bulutlar oluşur. Toprakların incelenmesinde su geçirmeyen ve su ile doymuş tabakalar “doygunluk tabakası” olarak adlandırılırlar.
Şu Sayfamız Çok Beğenildi
Sayısal Mantık Çözümlü Sorular

Yorumlar
Henüz yorum yapılmamış.